Marco Gobbi
Tratto da: "Caratterizzazione e diffusione delle specie aliene acquatiche e di ambienti umidi in Umbria" (Capitolo 14)
Riassunto
L’introduzione di specie alloctone può determinare un impatto negativo sotto il profilo sanitario con gravi alterazioni dei delicati sistemi demografici e dei meccanismi ecologici, che regolano il rapporto ambiente-patogeno-ospite, con conseguenze che apportano modifiche anche sul piano epidemiologico. L’impatto delle specie alloctone può essere quindi di grosse dimensioni anche dal punto di vista socio-sanitario.
Tali specie possono comportarsi in diversi modi:
a) favorire l’introduzione di un nuovo patogeno nell’ecosistema;
b) garantire la formazione di un nuovo serbatoio epidemiologico o il contributo numerico alla costituzione di un più abbondante serbatoio;
c) favorire la formazione di un substrato per l’acquisizione o aumento di virulenza di organismi scarsamente patogeni. Il presente contributo affronta quindi in modo dettagliato i principali aspetti sanitari delle invasioni biologiche, come ad esempio il problema sanitario legato al virus dell’influenza aviaria (virus ad alta patogenicità H5N1) e il ruolo dell’avifauna nella sua diffusione; il ruolo di Aedes albopictus nella diffusione di malattie virali emergenti (Dengue, Chikungunya e Zika); l’introduzione del gambero della Louisiana (Procambarus clarkii) e l’introduzione dell’agente patogeno dell’afanomicosi o Peste del gambero, Afanomices astaci, oppure la pseudorasbora (Pseudorasbora parva) serbatoio di Spheruectum destrues; il rischio per la salute umana rappresentato dalle specie dei roditori alloctoni, e i rapporti delle cianotossine con le specie alloctone. L’impatto delle specie aliene sulla salute umana è diventato di recente una questione fondamentale ma mancano in gran parte valutazioni approfondite di questo argomento. È necessario quindi che vengano sviluppati progetti interdisciplinari che colmino le lacune tra ecologi, ricercatori medici, socioeconomisti e autorità sanitarie pubbliche, e che colleghino la presenza delle specie aliene agli andamenti degli impatti che le specie stesse hanno.
Introduzione
Le invasioni biologiche rappresentano uno dei maggiori rischi per la conservazione della bio diversità. Questi fenomeni, che di sovente avvengono in maniera incontrollata, possono portare ad una grave alterazione dell’habitat e hanno senza dubbio un impatto negativo anche sotto il profilo sanitario (Lanfranchi e Guberti, 1997). L’introduzione infetti di specie alloctone può determinare gravi alterazioni dei delicati sistemi demografici e dei meccanismi ecologici, che regolano il rapporto ambiente-patogeno-ospite, con conseguenze che apportano modifiche anche sul piano epidemiologico. Un agente eziologico necessita di un gruppo di animali, appartenenti a una o più specie, in grado di permettere la persistenza dello stesso nell’ambiente. È ovvio che, sia introducendo nuovi ospiti che nuovi patogeni vengono a modificarsi questi rapporti. Le possibili azioni che possono essere svolte dalle specie alloctone e che possiedono un valore da un punto di vista sanitario sono molteplici, e l’impatto può essere di grosse dimensioni anche dal punto di vista socio-sanitario: ne è un esempio l’introduzione in nuovi territori, nonché la ricombinazione genetica, di virus influenzali, in parte legata ai movimenti migratori di anatidi selvatici, e l’attenzione mediatica che essa provoca.
Le specie alloctone possono quindi comportarsi in diversi modi:
- favorire l’introduzione di un nuovo patogeno nell’ecosistema, come ad esempio l’introduzione del gambero della Louisiana (Procambarus clarkii) e l’introduzione dell’agente patogeno dell’afanomicosi o Peste del gambero, Afanomices astaci; oppure la pseudorasbora (Pseudorasbora parva) serbatoio di Spheruectum destrues;
- garantire la formazione di un nuovo serbatoio epidemiologico o il contributo numerico alla costituzione di un più abbondante serbatoio, come nel caso di Aedes albopictus per diverse malattie a trasmissione vettoriale;
- favorire la formazione di un substrato per la virulentazione di organismi scarsamente patogeni, come ad esempio i virus influenzali che possono ricombinare negli uccelli selvatici.
In natura non esistono popolazioni animali o singoli individui completamente esenti da agenti eziologici di malattia e, di conseguenza, ogni organismo andrebbe considerato come un ecosistema contenente una sua specifica biocenosi parassitaria (Cunningam, 1996).
L’influenza aviaria, migrazioni e pandemia
Il ruolo degli uccelli migratori nella diffusione dei virus altamente patogeni di influenza aviaria non è completamente chiaro, ma senza dubbio la presenza e l’utilizzo del Lago Trasimeno da parte di specie sensibili all’infezione da virus influenzali di tipo A, non può essere tralasciata. Ad esempio, nel 2006, durante il picco influenzale di H5N1, il virus fu isolato in località Cerreto, vicino Panicale, da un germano reale (Anas platyrhynchos) rinvenuto morto. Senza dubbio l’ampia diffusione dei virus influenzali nell’avifauna, insieme alle caratteristiche di elevata contagiosità, al notevole aumento degli episodi che coinvolgono i virus ad alta patogenicità, alle scarse misure in termini di biosicurezza nell’allevamento avicolo, e alla sempre più concreta possibilità che virus di tipo aviare possano essere trasmessi anche all’uomo, giustificano lo sforzo che tutti i paesi devono fare in termini di sorveglianza e di misure di controllo. Nonostante la diffusione inter umana sia estremamente limitata, è invece piuttosto verosimile che il virus dell'influenza aviaria e quello dell'influenza umana possano infettare lo stesso individuo con riassortimento dei due virus. Ciò faciliterebbe la trasmissione nella specie uomo, aumentando il rischio di una nuova pandemia. I virus influenzali sono membri della famiglia Orthomyxoviridae e sono classificati nei tipi A, B o C basati sulle differenze tra i loro nucleoproteina e gli antigeni della proteina della matrice. I virus capaci di infettare gli uccelli appartengono al tipo A. Inoltre i virus dell’influenza sono ulteriormente classificati in sottotipi in base agli antigeni delle proiezioni dell’emagglutinina (H) e della neuraminidasi (N) sulle loro superfici. Ci sono 16 sottotipi di emoaglutinine e 9 sottotipi neuraminidasi nei virus dell’influenza A. Tuttavia, ad oggi tutti i virus altamente patogeni (HPAI) che causano malattie generalizzate e non respiratorie appartengono ai sottotipi H5 o H7. Ogni anno si verificano in tutto il mondo focolai di influenza o epidemie risultato di mutazioni puntiformi (antigenic drift), che consentono al virus di evadere parzialmente la risposta immunitaria sviluppata nella popolazione a seguito di epidemie precedenti. Invece il manifestarsi di mutazioni importanti e particolarmente virulente (antigenic shift) è all’origine delle pandemie (Reperant et al., 2012). Gli animali svolgono un ruolo determinante nella comparsa di nuovi sottotipi virali, verso i quali l’uomo può risultare sprovvisto di copertura immunitaria. Rivestono particolare importanza ai fini della diffusione dei virus influenzale i volatili, domestici e non (Reperant et al., 2012). Per la sua importanza a livello mondiale, l’AI nel nostro paese fa parte delle malattie sottoposte a Piano Nazionale di Sorveglianza. Tale piano individua zone ad alto rischio (prevalentemente il nord est del paese) e zone a medio rischio di cui fa parte tutta l’Umbria e alcune province laziali (Fig.1).In particolare, rivestono un ruolo molto importante nell’epidemiologia della malattia gli Ordini degli Anseriformi e dei Caradriformi. I virus dell’influenza A circolano in molti uccelli acquatici, ma sono più diffusi nelle anatre (Anas spp.) e in particolare nel germano reale, nel quale sono stati trovati quasi tutti i sottotipi (Olsen et al., 2006). La prevalenza in queste specie varia stagionalmente da <10% in primavera/estate e tra il 10 e il 60% poco prima e durante la migrazione autunnale, e tale modello è valido sia in Eurasia sia in Nord America (Vandergrift et al., 2010). Tali variazioni stagionali sembra siano dovute all’aggregazione di animali giovani e dalle particolari condizioni ambientali che prolungano la so pravvivenza virale al di fuori dell’ospite. Fino alla comparsa e all’elevata diffusione del virus ad alta patogenicità H5N1, nel 2002, si pensava che i virus influenzali causassero poca morbilità e mortalità nelle specie selvatiche. In seguito si è dimostrato che gli animali infetti anche dai virus a bassa patogenicità possono sviluppare forme cliniche fino alla morte (Komar e Olsen, 2008). Gli Anseriformi mostrano spesso alte prevalenze di infezione, tuttavia l’ordine dei Caradriformi è più numeroso, migra in media distanze più lunghe, e ospita anche una serie diversificata di virus di influenza. Esistono delle differenze nel comportamento del virus nei confronti dei due, adesempio alcuni sottotipidi emoagglutinine(H13 e H16) sono stati isolati quasi esclusivamente da Caradriformi, e al contrario degli Anseriformi, mostrano prevalenze di infezione più alte in tarda primavera e inizio estate. Queste caratteristiche suggeriscono come alcuni Caradriformi possano avere un ruolo importante nel mantenimento del virus nelle popolazioni selvatiche(Krauss etal., 2007). L’importanza che riveste la sorveglianza che deve essere effettuate nelle aree a rischio influenza sull’avifauna selvatica è chiara se paragonata al rischio pandemico che i virus influenzali sono in grado di portare. Una pandemia può prendere il via quando si verificano tre condizioni:
- la comparsa di un nuovo sottotipo di virus influenzale;
- l’infezione di esseri umani, con conseguente malattia acuta;
- la diffusione rapida e sostenuta tra gli esseri umani.
Il virus H5N1 soddisfa ampiamente le prime due condizioni: è un nuovo virus per gli esseri umani (gli H5N1 non hanno mai circolato tra le persone), e ha infettato più di 100 esseri umani, causandone il decesso in nel 50% dei soggetti. Nel caso in cui dovesse comparire un virus del tipo H5N1 in grado di trasmettersi da uomo a uomo nessuno di noi sarebbe immune, e il rischio legato a questa condizione è possibile fintanto che il virus continuerà a circolare nelle popolazioni di uccelli domestici e selvatici.
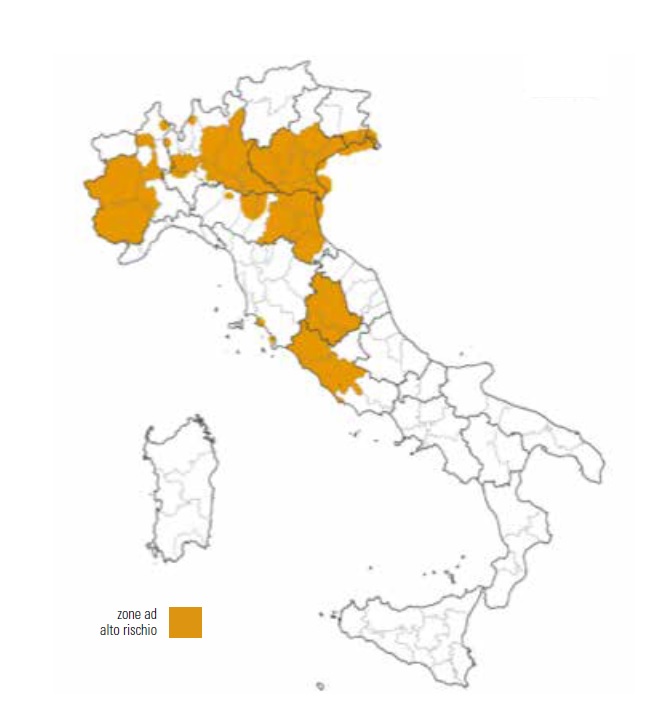
Figura 1 Zone di Rischio Influenza Aviaria HPAI (fonte: Piano Nazionale di Sorveglianza 2017)
Aedes albopictus e il suo ruolo nella diffusione di malattie virali emergenti
Le specie aviarie migratrici hanno un importante ruolo anche come serbatoio di altri patogeni virali, oltre all’influenza aviaria, di grande importanza per la salute pubblica, come ad esempio il virus della Malattia di West Nile (WNV). Questa malattia virale rientra nel gruppo di malattie umane a trasmissione vettoriale, le arbovirosi, insieme a Usutu (USUV), ma anche Dengue, Chikungunya e Zika. Queste ultime tre vedono come principale vettore gli insetti appertenenti al genere Aedes, mentre WNV e USUV hanno come principale vettore le zanzare del genere Culex, pur essendo riconosciuta nei nostri territori la competenza di Aedes albopictus come vettore della malattia (Mancini et al., 2017). A. albopictus è ormai stabilmente radicata nel nostro paese. A causa della localizzazione prevalentemente peridomestica dei focolai larvali, l’attività della “zanzara Tigre” pone problemi di natura igienico-sanitaria notevoli, ma spesso sottostimata dalle autorità competenti, col risultato che la specie può raggiungere localmente densità decisamente preoccupanti. WNV è endemica nei paesi africani, e si è diffusa nell’ultimo decennio in America, Medio Oriente, India e Europa meridionale. La malattia è causata da un virus appartenente al genere Flavivirus, la cui circolazione è amplificata nell’ambiente mediante un ciclo biologico zanzara-uccello-zanzara. Tra gli ordini di uccelli quelli che svolgono il ruolo di ospiti amplificatori sono Caradriformi e Passeriformi, tra i quali particolare importanza nell’ecologia del WNV rivestono soprattutto Ploceidi, Sturnidi e Corvidi. Tra gli uccelli domestici un certo ruolo possono svolgere gli Anseriformi, mentre Galliformi e Columbiformi mostrano viremie di breve durata e con titoli virali non elevati (Calzolari et al., 2010). Il virus può essere trasmesso tramite puntura di zanzara infetta all’uomo o al cavallo, che tuttavia sviluppano una viremia transitoria di scarsa durata e non sono a loro volta infettanti per le zanzare. In circa il 20% delle persone infettate compare una malattia febbrile che si risolve spontaneamente in pochi giorni (Hubalek e Halouzka, 1999). Tuttavia pazienti immunodepressi possono sviluppare una forma neuro-invasiva: encefalite, meningo-encefalite o paralisi flaccida acuta. Queste forme hanno un tasso di letalità che può arrivare al 3-15%. Strettamente correlato al virus WND è il virus Usutu (USUV), riscontrato nei roditori e negli uccelli di vari paesi africani e che inizia ad essere piuttosto diffuso in Europa centrale e occidentale. Esistono evidenze sierologiche di infezioni USUV negli uccelli selvatici nel Regno Unito. Nel 2001, il virus è stato identificato quale causa di morte in numerosi uccelli selvatici e in cattività in Austria, nel 2007 è stato isolato in polli domestici (Emilia-Romagna) e nel 2009 in merli (Turdus merula) trovati morti nel Nord-est italiano. Nel 2009 sono stati descritti due casi umani (Pecorari et al. 2009; Cavrini et al., 2009). La competenza di A. albopictus come vettore della malattia è bassa, tuttavia vi sono evidenze di un possibile adattamento del virus al vettore biologico (Puggioli et al., 2017). In Italia l’Umbria non rientra nelle zone considerate endemiche per WND e Usutu dal “Piano nazionale integrato di sorveglianza e risposta ai virus West Nile e Usutu – 2017”, tuttavia rimane importante la sorveglianza delle specie sensibili e d’obbligo la sorveglianza sierologica degli equini in quanto ospiti rilevatori. Il monitoraggio effettuato dall’Istituto Zooprofilattico Sperimentale dell’Umbria e delle Marche su 347 corvidi, oggetto di piani di abbattimento nella regione Umbria nel 2016, ha dato esito negativo per tutti i campioni analizzati. Anche la Dengue è data da un Flavivirus ed è endemica di molti paesi dell’emisfero australe. Si stima che causi circa 20.000-25.000 decessi annui, soprattutto in età infantile. La malattia clinicamente si manifesta con febbre alta, mal di testa, dolori muscolari e alle articolazioni, rash cutaneo e piccole emorragie (Figarelli e Gagarelli, 2012) tale sintomatologia raramente dura più di dieci giorni. In meno del 5% dei casi si presenta in forma severa, dengue emorragica o dengue con shock, che può avere esito fatale. La Chikungunya è una manifestazione patologica data da un Togovirus, endemico anch’esso dei paesi africani. Quando clinicamente manifesta si caratterizza per un’insorgenza improvvisa con febbre alta, brividi, mal di testa, nausea e vomito, fotofobia, artralgie con importanti limitazioni funzionali (il nome della malattia nella lingua Makonde significa “ciò che rende curvi”) e eruzioni cutanee. La fase acuta della malattia si risolve, di norma, in una decina di giorni; dolori articolari ricorrenti possono persistere per mesi o anni. Nelle persone più anziane l’artralgia può addirittura cronicizzare. La letalità è un evento raro, ma possibile (Figarelli e Gagarelli, 2012). A fine settembre 2017 è stato isolato il virus responsabile del focolaio di Chikungunya nel Lazio. L’isolamento del virus è utile per capire meglio quale ceppo è implicato nell’epidemia e per poter valutare la competenza delle zanzare autoctone nella trasmissione della malattia. Al 6 ottobre 2017, il Ministero della Salute, riferisce in un totale di 282 notifiche (156 confermati e 126 probabili) di casi di Chikungunya in Italia (fonte: http://www.epicentro.iss.it/problemi/Chikungunya/Italia2017.asp). Il virus Zika è anch’esso un Flavivirus, trasmesso da Aedes spp.. A differenza di WNV e USUV, il soggetto punto da una zanzara portatrice e nuovamente punto da una zanzara non infetta, può dare origine a un focolaio endemico. Il contagio interumano è possibile e può avvenire attraverso i liquidi biologici.In Italia, la sorveglianza dei casi di malattia da virus Chikungunya, Dengue e Zika è regolata dal “Piano nazionale di sorveglianza e risposta alle arbovirosi trasmesse da zanzare (Aedes spp.) con particolare riferimento a virus Chikungunya, Dengue e virus Zika – 2016”. Il sistema viene potenziato nel periodo di maggiore attività vettoriale per permettere l’identificazione rapida dei casi e l’eventuale adozione immediata delle necessarie misure di controllo. La comparsa di focolai di tali malattie, in paesi dal clima temperato come l’Italia, ma anche la semplice circolazione di vettori di patologie, ancora considerate esotiche, e l’adattamento di tali vettori al clima temperato, o ancora la nuova competenza dei vettori a patogeni già presenti sul territorio, sono situazioni che ci dimostrano come il rischio che la globalizzazione comprenda anche criticità per la salute umana sia divenuto realtà. Per far fronte a tale situazione è necessario sviluppare prontamente sistemi di sorveglianza adeguati ed implementare le capacità diagnostiche sul territorio.
Le specie alloctone di gambero: tra conservazione e sicurezza alimentare
Uno degli esempi di maggiore rilievo di quanto le specie invasive possano essere impattanti dal punto di vista sanitario ci viene senza dubbio dalla micosi portata dall’Aphanomyces astaci, responsabile della così detta “Peste del Gambero” o afanomicosi.
Tale patogeno possiede un ciclo vitale semplice, con riproduzione asessuata tramite zoospore mobili biflagellate che in acqua vengono attratte chemiotatticamente dalla cuticola dell’ospite. La zoospora aderisce tramite i flagelli e tramite enzimi lipolitici e chitinolitici perfora la cuticola. Invade poi l’ipoderma tramite un tubo germinativo e inizia ad invadere l’ipoderma tramite ife vegetative con attività chitinasica e proteasica. Raramente, in questa fase, le ife diffondono in modo massivo agli organi interni.
La morte dell’ospite avviene tramite la produzione di una neurotossina da parte dell’oomicete. Il ciclo si completa con la produzione di sporangi, da parte delle ife, che fuoriescono dalla cuticola dell’ospite e si dispongono all’esterno della carcassa. All’interno degli sporangi si formano le nuove zoospore ameboidi primarie che in poche ore rilasciano le zoospore secondarie infettanti (Quaglio etal. 2011). Tutte le specie di gambero Europee e Nordamericane sono suscettibili all’afano micosi, Tuttavia, nelle specie molto suscettibili, quali il nostrano gambero di fiume (Austropotamobius pallipes), A. astaci molto spesso riesce ad invadere la lamina basale e gli organi sottostanti, mentre nelle specie Nordamericane si localizza quasi esclusivamente a livello della cuticola addominale. Queste ultime in normali condizioni non sviluppano malattia clinica e si comportano quindi da vettori del micete, rimanendo persistentemente infetti dal micete e mettendo a rischio le specie europee (Svoboda et al., 2017).Se molto si è scritto e studiato riguardo al ruolo delle specie aliene di gambero, in particolar modo per quanto riguarda Procambarus clarkii e il suo ruolo nella diffusione dell’afanomicosi, di altrettanto rilievo è la capacità di questa specie di sopravvivere in ambienti colpiti da bloom algali e di accumulare tossine potenzialmente pericolose per la salute umana (Piscia et al. 2011), qualora venissero consumati come alimento. Esistono inoltre diversi studi volti a misurare i livelli di bioaccumulo di metalli pesanti in P. clarkii, anche se l’utilizzo di questa specie nei programmi di biomonitoraggio delle acque deve essere fatta con cautela, considerando che esistono differenze importanti per quanto riguarda la stagione e il sesso degli animali campionati (Elia et al., 2006). Tuttavia, P. clarkii presenta una notevole capacità di bioaccumulo (Suarez-Serrano et al., 2010) che può portare questi metalli pesanti a livelli trofici più elevati. Un ulteriore aspetto che deve essere preso in considerazione è il ruolo che possono avere le specie di gamberi alloctoni nella diffusione di patogeni zoonotici. È il caso di alcuni focolai umani di tularemia (malattia causata dal batterio Francisella Tularensis), associati al consumo di P. clarkii in Spagna (Anda et al., 2001). Normalmente associata al consumo di alimenti contaminati, alla manipolazione di selvaggina, o al morso di insetti vettori, la tularemia è una zoonosi grave, e il batterio responsabile è classificato come classe A dal Centre of Diseases Control negli Stati Uniti. Il riscontro del batterio nell’epatopancreas di P. clarki pone la necessità di ulteriori studi sul suo ruolo di vettore della malattia.
Pseudorasbora parva, un cavallo di Troia per la biodiversità
La pseudorasbora (Pseudorasbora parva) viene considerata una delle 100 specie più invasive per diverse caratteristiche ecologiche della specie, ma anche perché è vettore di una grave patologia, causata dal Sphaerothecum destruens, incluso nella classe Mesomicetozoa. Tale parassita intracellulare infetta gli organi interni del suo ospite, causando degradazione tissutale e morte cellulare (Arkush et al. 1998). S.destruens è in grado di infettare e causare alta mortalità in diverse specie di salmonidi (Arkush et al., 1998; Paley et al., 2012) e ciprinidi (Gozlan et al., 2005; Andreou et al., 2011). A livello mondiale, il suo è stato notevole impatto su specie sia di importanza commerciale ma anche su specie di elevato interesse conservazionistico come il salmone Chinook (Oncorhynchus tshawytscha) e l’alborella fasciata (Leucaspius delineatus). La rapida diffusione di questo patogeno in Europa è dovuta alla diffusione del suo ospite, la Pseudorasbora appunto (Copp et al., 2010), ed ha senza dubbio contribuito alla riduzione delle popolazioni europee di L. delineatus (Gozlan et al., 2005). La presenza di un ospite sano, che può fungere da serbatoio di malattia, può avere risvolti di grande rilievo sulla patogenicità di specie come S. destruens. Infatti in patogeni a singolo ospite, è ben mantenuto l’equilibrio tra trasmissione e virulenza del patogeno stesso. Tuttavia, l’introduzione di altri ospiti può alterare tale equilibrio e causare un aumento della virulenza del patogeno (Woolhouse et al., 2001). Per tale motivo, se S. destruens rappresenta una minaccia importante per la biodiversità ittica in tutto il mondo, la presenza di un suo ospite portatore sano nelle acque interne dell’Umbria pone senza dubbio a rischio un ambiente ricco di specie native come quello dei bacini regionali.
Roditori alloctoni, un rischio per la salute umana?
È opinione comune e diffusa che la nutria (Myocastor coypus) sia uno dei serbatoi di Leptospira, nonostante diversi studi a livello nazionale e europeo dimostrino il ruolo marginale che riveste questo animale nella diffusione della malattia, cosa che tuttavia non può essere affermata per il ratto grigio (Rattus norvegicus), vero serbatoio della malattie che molto spesso, tuttavia, condivide l’areale con la nutria.In particolare si direbbe che le popolazioni di nutria siano solo delle riserve secondarie di Leptospira spp..
Da indagini sierologiche condotte su 87 individui in Nord Italia (Bollo et al., 2003) si è rilevata la presenza di anticorpi contro Leptospira bratislava (11.5%) e Leptospira icterohaemorrhagiae (3.4%) ma non si è osservata alcuna relazione tra la presenza di anticorpi e la presenza di lesioni renali negli animali esaminati. Le ricerche condotte in Francia su roditori selvatici, compresa la nutria (Aviat et al., 2009) hanno dimostrato una sieropositività alla MAT (Microscopic Agglutination Test) variabile dal 20% al 55% indipendentemente dalla specie presa in esame, ed una presenza di DNA di Leptospira, rilevata con PCR (Polymerase Chain Reaction) direttamente da organo renale, variabile tra il 3,3% e il 5% nelle nutrie, mentre altre specie (Rattus norvegicus e il topo muschiato, Ondatra zibethicus) mostravano prevalenze nettamente più elevate (rispettivamente 34,8% e 15,8%); tali rilievi stanno a significare che anche la nutria, così come altri animali selvatici e di allevamento che vivono nelle zone in cui è diffuso il vero reservoir di Leptospira spp., il ratto grigio, può contrarre l’infezione e sviluppare una risposta immunitaria ad essa (positività sierologica) ma il rilievo di frazioni di DNA di Leptospira (positività alla PCR) nei tessuti e quindi la sua capacità di eliminare il parassita con le urine, è estremamente rara. La nutria si conferma quindi come una portatrice secondaria di Leptospira spp., e questo dato potrebbe essere anche legato all’ecologia della specie, che condivide ambiente e molte abitudini con la specie serbatoio, rimanendo tuttavia meno esposta all’infezione. Tralasciando il ruolo che questa specie ha avuto in passato nella diffusione della Peste Nera, la più grande epidemia che abbia mai colpito la specie umana, il ratto grigio è fondamentale nell’epidemiologia di diversi patogeni, zoonotici e non, e la sua presenza sul territorio incide in maniera importante sia a livello sociale, che sanitario ed economico. Rattus norvegicus rientra nel ciclo di Trichinella spp., parassita nematode di molte specie animali. La presenza di ratti in aree a vocazione rurale e in vicinanza degli allevamenti può aumentare il rischio di trasmissione del parassita a animali da reddito (suini) e quindi all’uomo (Agerholm, 2013). La specie patogena presente in Umbria è Trichinella britovi, mentre sono segnalati in Italia focolai di Trichinella pseudospiralis, e recentemente è stata isolata nel nostro paese da due volpi (Vulpes vulpes) anche la più patogena Trichinella spiralis (Garbarino et al., 2017). I ratti sinantropici come Rattus norvegicus possono amplificare la biomassa T. spiralis e agire come vettore del parassita nei suini domestici (Pozio, 2014). L’importanza che riveste la presenza di specie patogene di Trichinella sul territorio è tale che tutti i suini macellati vengono sottoposti a esame trichinoscopico per la rilevazione del parassita, con costi enormi per la sanità pubblica. Il ratto, come la maggior parte delle specie che vivono in ambienti umidi, è in grado di fungere da serbatoio di Toxoplasma gondii, altro patogeno zoonotico di estrema rilevanza per l’igiene alimentare, e fungere quindi da preda per l’ospite definitivo maggiormente diffuso del parassita, il gatto domestico (Felis silvestris catus). Interessante, da questo punto di vista, è la maggiore l’alterato comportamento verso i predatori che i ratti infetti da Toxoplasma avrebbero rispetto ai non infetti, a dimostrazione che il parassita, che può localizzarsi a livello del sistema nervoso centrale, è in grado di modificare il comportamento della specie ospite per favorirne la predazione (Berdoy et al., 2000; House et al., 2011). Il ratto è poi serbatoio di Coxiella burnetii, agente patogeno della Febbre Q, malattia zoonotica tipica del bestiame domestico, e in alcuni paesi europei raggiunge prevalenze del 55% (Webster et al., 1995) nei roditori sinantropici, ponendosi come serio fattore di rischio di trasmissione del patogeno agli animali domestici e conseguentemente all’uomo (Reusken et al., 2011).
Le cianotossine e i loro rapporti con le specie alloctone
I cianobatteri, colonizzatori degli ecosistemi acquatici, possono essere annoverati tra i microrganismi patogeni emergenti. Molte specie, infatti, producono come metaboliti secondari una grande varietà di tossine (cianotossine) potenzialmente pericolose per la salute, attraverso l’ingestione di alimenti o acque potabili contaminate, oppure lo svolgimento di attività quali la balneazione. Per tale ragione, le cianotossine esistenti presentano vari meccanismi di tossicità e, a seconda dell’organo bersaglio, possono essere suddivise in quattro diversi gruppi: epato tossine, neurotossine, citotossine e dermatotossine. Molto spesso ogni cianobatterio produce diverse tossine. Tuttavia, la produzione di tossine non è costante e può variare molto in risposta a fattori biotici e abiotici.Molto diffuse sono le microcistine, epatotossine spesso prodotto delle fioriture di Mycrocists aeruginosa, che posseggono una struttura stabile che permette loro di rimanere attive per molto tempo all’interno dell’ambiente acquatico, ed essere quindi in grado di portare ad una prolungata esposizione e di produrre malattie gravi. In effetti, alcune microcistine sono promotori tumorali. Al contrario, alcuni cianobatteri alloctoni, quali Planktothrix agardhii e Cylindrospermopsis raciborskii, sono in grado di produrre saxitossine, neurotossine instabili, che possono essere causa di intossicazioni gravi di tipo acuto (Molica et al., 2002). Una delle cause di aumento della presenza di cianobatteri è stata attribuita alla comparsa in alcuni bacini della cozza zebrata (Dreissena polymorpha). I dreissenidi promuovono i cianobatteri attraverso il processo di rifiuto selettivo (Vanderploeg et al., 2001). Poiché i dreissenidi filtrano indistintamente il fitoplancton dall’acqua, rifiutano i ceppi tossici di cianobatteri come pseudofeci.
Questi elementi cellulari crescono rapidamente a causa della diminuzione della concorrenza nutritiva del fitoplancton filtrata e assimilata dalle cozze. La presenza inoltre di cianotossine nel lago Trasimeno può essere messo in relazione con la presenza del carassio (Carassius auratus). La specie infatti può favorire l’accrescimento dei cianobatteri, stimolati dal passaggio attraverso l’intestino del carassio (Kolmakov e Gladyshev, 2003). Alcuni studi mettono poi in correlazione la presenza di gamberi della Lousiana (Procambarus clarkii), che possiedono la capacità di resistere a stress ambientali importanti, all’aumento della densità di cianobatteri. Inoltre, nello stesso studio sperimentale, le densità di popolazione dei cianobatteri hanno cominciato a diminuire dopo che il gambero è stato rimosso (Yamamoto, 2010). L’apparizione dei cianobatteri nei corpi idrici è sempre di maggiore riscontro ed è un fattore importante nell’eutrofizzazione delle acque. Spesso gli effetti della presenza dei batteri possono essere legati a episodi di tossicità acuta per animali domestici e fauna selvatica, ma soprattutto a episodi acuti o cronici per gli esseri umani.
Conclusioni
Le implicazioni di aspetto sanitario legate alla presenza di specie alloctone possono essere davvero molteplici, e la loro trattazione rischia di avere bisogno di spazi e tempi davvero imponenti. L’impatto delle specie aliene sulla salute umana è diventato di recente una questione fondamentale sia per quello che riguarda la ricerca in campo medico che ecologico, ma in gran parte mancano valutazioni approfondite di questo argomento.
Una recente review critica (Schindler et al., 2015) della letteratura scientifica a riguardo, conclude che la ricerca europea sugli impatti delle specie aliene in materia di salute umana è, in gran parte, pregiudizievole verso alcune specie e che, diversi aspetti importanti, come gli stadi di invasione precoce, la gravità dell’impatto e le sue tendenze temporali, nonché la portata dei costi socioeconomici causati, sono poco analizzati e quindi scarsamente compresi. Per questo, è necessario che vengano sviluppati progetti interdisciplinari che colmino le lacune tra ecologi, ricercatori medici, socioeconomisti e autorità sanitarie pubbliche, e che colleghino la presenza delle specie aliene alla gravità e agli andamenti degli impatti che le specie stesse hanno. Questo è un requisito essenziale per la valutazione del rischio e alla base dell’implementazione di un corretto processo decisionale.
Bibliografia
Agerholm, J. S. (2013). Coxiella burnetii associated reproductive disorders in domestic animals-a critical review. Acta Veterinaria Scandinavica, 55(1), 13.
Anda, P., Del Pozo, J. S., García, J. D., Escudero, R., Pena, F. G., Velasco, M. L., ... & Navarro, J. M. (2001). Waterborne outbreak of tularemia associated with crayfish fishing. Emerging infectious diseases, 7(3 Suppl), 575.
Andreou, D., Gozlan, R. E., Stone, D., Martin, P., Bateman, K., & Feist, S. W. (2011). Sphaerothecum destruens pathology in cyprinids. Diseases of aquatic organisms, 95(2), 145-151.
Arkush, K. D., Frasca Jr, S., & Hedrick, R. P. (1998). Pathology associated with the rosette agent, a systemic protist infecting salmonid fishes. Journal of Aquatic Animal Health, 10(1), 1-11.
Berdoy, M., Webster, J. P., & Macdonald, D. W. (2000). Fatal attraction in rats infected with Toxoplasma gondii. Proceedings of the Royal Society of London B: Biological Sciences, 267(1452), 1591-1594.
Bollo, E., Pregel, P., Gennero, S., Pizzoni, E., Rosati, S., Nebbia, P., & Biolatti, B. (2003). Health status of a population of nutria (Myocastor coypus) living in a protected area in Italy. Research in veterinary science, 75(1), 21-25.
Calzolari, M., Bonilauri, P., Bellini, R., Albieri, A., Defilippo, F., Maioli, G., ... & Lelli, D. (2010). Evidence of simultaneous circula- tion of West Nile and Usutu viruses in mosquitoes sampled in Emilia-Romagna region (Italy) in 2009. PLoS One, 5(12), e14324.
Cavrini, F., Gaibani, P., Longo, G., Pierro, A. M., Rossini, G., Bonilauri, P., ... & Dottori, M. (2009). Usutu virus infection in a pa- tient who underwent orthotropic liver transplantation, Italy, August-September 2009. Euro surveillance: bulletin Europeen sur les maladies transmissibles= European communicable disease bulletin, 14(50).
Copp, G. H., Vilizzi, L., & Gozlan, R. E. (2010). Fish movements: the introduction pathway for topmouth gudgeon Pseudorasbora parva and other non‐native fishes in the UK. Aquatic Conservation: Marine and Freshwater Ecosystems, 20(3), 269-273.
Cunningham, A. A. (1996). Disease risks of wildlife translocations. Conservation biology, 10(2), 349-353.
Elia, A. C., Dörr, A. J. M., Mastrangelo, C., Prearo, M., & Abete, M. C. (2006). Glutathione and antioxidant enzymes in the hepato- pancreas of crayfish Procambarus clarkii (Girard, 1852) of Lake Trasimeno (Italy). Bulletin Français de la Pêche et de la Piscicul- ture, (380-381), 1351-1361.
Figarelli, A.P., & Gagarelli R. (2012). In Europa aumentano i casi di malattie da zanzare. Ecoscienza. n 3 anno 2012.
Garbarino, C., Interisano, M., Chiatante, A., Marucci, G., Merli, E., Arrigoni, N., ... & La Rosa, G. (2017). Trichinella spiralis a new alien parasite in Italy and the increased risk of infection for domestic and wild swine. Veterinary Parasitology, 246, 1-4.
Gozlan, R. E., St-Hilaire, S., Feist, S. W., Martin, P., & Kent, M. L. (2005). Biodiversity: disease threat to European fish. Natu- re, 435(7045), 1046-1046.
House, P. K., Vyas, A., & Sapolsky, R. (2011). Predator cat odors activate sexual arousal pathways in brains of Toxoplasma gondii infected rats. PloS one, 6(8), e23277.
Hubalek, Z., & Halouzka, J. (1999). West Nile fever--a reemerging mosquito-borne viral disease in Europe. Emerging infectious diseases, 5(5), 643.
Kolmakov, V. I., & Gladyshev, M. I. (2003). Growth and potential photosynthesis of cyanobacteria are stimulated by viable gut passage in crucian carp. Aquatic Ecology, 37(3), 237-242.
Komar, N., & Olsen, B. (2008). Avian influenza virus (H5N1) mortality surveillance. Emerging infectious diseases, 14(7), 1176.
Krauss, S., Obert, C. A., Franks, J., Walker, D., Jones, K., Seiler, P., ... & Widjaja, L. (2007). Influenza in migratory birds and evidence of limited intercontinental virus exchange. PLoS Pathogens, 3(11), e167.
Lanfranchi, P., & Guberti, V. (1997). Aspetti sanitari delle immissioni faunistiche. Atti III Convegno Nazionale dei Biologi della Selvaggina, Suppl. Ric. Biol. Selvaggina, 27, 47-60.
Mancini, G., Montarsi, F., Calzolari, M., Capelli, G., Dottori, M., Ravagnan, S., Federici, V. (2017). Mosquito species involved in the circulation of West Nile and Usutu viruses in Italy. Veterinaria Italiana, 53(2), 97-110.
Molica, R., Onodera, H., García, C., Rivas, M., Andrinolo, D., Nascimento, S., ... & Lagos, N. (2002). Toxins in the freshwater cyanobacterium Cylindrospermopsis raciborskii (Cyanophyceae) isolated from Tabocas reservoir in Caruaru, Brazil, including demonstration of a new saxitoxin analogue. Phycologia, 41(6), 606-611.
Olsen, B., Munster, V. J., Wallensten, A., Waldenström, J., Osterhaus, A. D., & Fouchier, R. A. (2006). Global patterns of influenza A virus in wild birds. science, 312(5772), 384-388.
Paley, R. K., Andreou, D., Bateman, K. S., & Feist, S. W. (2012). Isolation and culture of Sphaerothecum destruens from Sunbleak (Leucaspius delineatus) in the UK and pathogenicity experiments in Atlantic salmon (Salmo salar). Parasitology, 139(7), 904-914.
Pecorari, M., Longo, G., Gennari, W., Grottola, A., Sabbatini, A. M., Tagliazucchi, S., ... & Rumpianesi, F. (2009). First human case of Usutu virus neuroinvasive infection, Italy, August-September 2009. Eurosurveillance, 14(50), 19446.
Piscia, R., Volta, P., Boggero, A., & Manca, M. (2011). The invasion of Lake Orta (Italy) by the red swamp crayfish Procambarus clarkii (Girard, 1852): a new threat to an unstable environment. Aquatic Invasions, 6(1), S45-S48.
Pozio, E. (2014). Searching for Trichinella: not all pigs are created equal. Trends in parasitology, 30(1), 4-11.
Puggioli, A., Bonilauri, P., Calzolari, M., Lelli, D., Carrieri, M., Urbanelli, S., ... & Bellini, R. (2017). Does Aedes albopictus (Diptera: Culicidae) play any role in Usutu virus transmission in Northern Italy? Experimental oral infection and field evidences. Acta Tropica, 172, 192-196.
Quaglio, F., Gustinelli, A., & Manfrin, A. (2011). Pathology of freshwater crayfish. Infectious and mycotic diseases. Ittiopatologia, 8.
Reperant L.A., Osterhaus ADME, Kuiken T.- (2012). Influenza virus infections. In: D. Gavier-Widen JP Duff, and A Meredith, editors.Infectious diseases of wild mammals and birds in Europe; Wiley-Blackwell, West Sussex, U.K., pp. 37–58.
Reusken, C., van der Plaats, R., Opsteegh, M., de Bruin, A., & Swart, A. (2011). Coxiella burnetii (Q fever) in Rattus norvegicus and Rattus rattus at livestock farms and urban locations in the Netherlands; could Rattus spp. represent reservoirs for (re) introduction?. Preventive veterinary medicine, 101(1), 124-130.
Schindler, S., Staska, B., Adam, M., Rabitsch, W., & Essl, F. (2015). Alien species and public health impacts in Europe: a literature review. NeoBiota, 27, 1.
Suarez-Serrano, A., Alcaraz, C., Ibanez, C., Trobajo, R., & Barata, C. (2010). Procambarus clarkii as a bioindicator of heavy metal pollution sources in the lower Ebro River and Delta. Ecotoxicology and environmental safety, 73(3), 280-286.
Svoboda, J., Mrugała, A., Kozubíková‐Balcarová, E., & Petrusek, A. (2017). Hosts and transmission of the crayfish plague pathogen Aphanomyces astaci: a review. Journal of fish diseases, 40(1), 127-140.
Vandegrift, K. J., Sokolow, S. H., Daszak, P., & Kilpatrick, A. M. (2010). Ecology of avian influenza viruses in a changing world. Annals of the New York Academy of Sciences, 1195(1), 113-128.
Vanderploeg, H. A., Liebig, J. R., Carmichael, W. W., Agy, M. A., Johengen, T. H., Fahnenstiel, G. L., & Nalepa, T. F. (2001). Zebra mussel (Dreissena polymorpha) selective filtration promoted toxic Microcystis blooms in Saginaw Bay (Lake Huron) and Lake Erie. Canadian Journal of Fisheries and Aquatic Sciences, 58(6), 1208-1221.
Webster, J. P., Lloyd, G., & Macdonald, D. W. (1995). Q fever (Coxiella burnetii) reservoir in wild brown rat (Rattus norvegicus) populations in the UK. Parasitology, 110(1), 31-35.
Woolhouse, M. E., Taylor, L. H., & Haydon, D. T. (2001). Population biology of multihost pathogens. science, 292(5519), 1109-1112.
Yamamoto, Y. (2010). Contribution of bioturbation by the red swamp crayfish Procambarus clarkii to the recruitment of bloom-forming cyanobacteria from sediment. Journal of Limnology, 69(1), 102-111.*
Tratto da:

"Caratterizzazione e diffusione delle specie aliene acquatiche e di ambienti umidi in Umbria"
Anno di pubblicazione 2019
Arpa Umbria
Autori vari / a cura di Valentina Della Bella, Arpa Umbria